有機化合物の構造や性質、反応機構を記述するために,きわめて有用な表記法です。有機化学の基本となるので確実に身に着けてほしい。
ルイス構造式の書き方
1.
構成原子に価電子(最外殻電子)を・示す。電子は、できるだけ空軌道を作らないように、そして、電子対をつくるように配置する。
2.
全ての構成原子が最外殻を満たすように(オクテット則)、そして、全ての電子が対になるように結合をつくる。第二周期元素の場合、オクテット則を超えて8個以上の電子を配置することは厳禁です。
例)CH4Oのルイス構造を描いてみましょう。各原子の最外殻電子を点で描き、電子対を作り、オクテットを完成するように共有結合を作れば、メタノール分子が完成すると思います。
また、電子を点で表記すると煩雑になるので、電子対を結合(-)で表記したもの(図の右側)がKekule構造です。
ルイス構造を描くといろいろなことは解ります。
l 全ての原子が最外殻を満たしています。
l 電子対には、共有結合に関わる共有電子対と関わらない孤立電子対がある。それらは、分子を壊さない限り、入れ替えられない。
l 電気的に中性の原子同士が1個ずつ電子を出し合って共有結合を形成しているので、分子全体も電気的に中性です。
l CH4Oでできる分子中の電子配置は1種類です。
このような方法でもっと複雑な分子も組み立てられます。一挙に分子を組み立てられない場合は、まず構成原子の一部で小さな分子や原子団を作り、ブロック同士を結合させることを考えたら良いかと思います。その際、3員環や4員環を持つ分子や同一原子が連続する分子(炭素は例外)は限られているのでできるだけ除外した方が良いかと思います。
高校化学では構造がわかれば十分かと思いますが、ルイス構造からはもっと多くの分子情報が得られます。
共鳴構造
多くの分子は原子配置が決まると、電子配置も一通りに決まります。しかし、原子配置は同じでも、複数の電子配置が存在する分子もあります。CO2とCOのルイス構造式を考えてください。
CO2の場合はCとOが2個ずつ電子を出し合って二重結合を作れば、“完全な分子”をつくることができます。
ところがCOの場合はそうはゆきません。CとOが2個ずつ電子を出し合って二重結合を作れば、Oは最外殻を満たすことができるが、Cは最外殻が6電子になってしまいます。両者の最外殻を満たすためにはCは2個そしてOは4個の電子を出し合って三重結合を作る必要があります。その結果、電子を多く出したOは+の電荷を持ち、少なく電子を出したCは-の電荷を持つことになります。いずれにしても“完全な分子”はできません。COの2つのルイス構造は、原子の配置は同一で、一つの電子対を移動させると相互変換することができます。このような関係を共鳴といいます。いくつかの共鳴構造を持つ分子は、そうでない分子に比べて安定になります。
形式電荷
原子は電気的に中性ですから、同数の電子を出し合って共有結合を形成すれば電荷は生じません。ところが、:C:::O: のように2+4の不平等な共有結合を形成すると電荷が生じます。これを形式電荷といいます。CとOは原子状態の最外殻原子数は4個と6個ですが、この分子ではCは5個、Oも5個になったとみなします(共有結合の6個の電子はCとOで折半する)。計算上、原子状態より電子数が増えたCは-に、同様にOは+の電荷を持つことになります。
水分子とオキソニウムイオンで考えましょう。
左側は水素原子から電子1個失った水素イオンは+、水分子はOとHが同数の電子を出し合って対等な共有結合を作っているので形式電荷はありません。右側のオキソニウムイオンでは赤で示したOの孤立電子対と水素イオンで共有結合を作っているので、計算上、Oは電子を1つ失ったので+の形式電荷を持ちます。
形式電荷は計算式(中性原子の価電子数ー共有結合数ー孤立電子数)で求められますが、計算に頼らず、構造式を見て求められるようになって欲しいと思います。
オクテット則に従う原子について、場合分けすると次のようになります(ホウ素のように6電子の分子を作る原子は当てはまりません。また、結合数が2つ以上違う場合も当てはまらないので、計算式を使ってください)。
・原子価通りの結合数を持つ原子:形式電荷なし。
・原子価より1つ結合数が多い原子:+
・原子価より1つ結合数が少ない原子
孤立電子対を持つ場合:-
孤立電子がない場合: +
つまり、構造式を良く見て原子価に異常のある原子に注目すれば良いのです。これまでに出たルイス構造式で見てみましょう。メタノールの場合はC(結合数4)、H(結合数1)、O(結合数2)全て原子価通りなので形式電荷はありません。二酸化炭素の場合もC(結合数4)、O(結合数2)なので形式電荷なし。2重結合のCOは、Cは結合数2なので計算式(4-2-2=0)から電荷なし、Oも原子価通りで電荷なし。3重結合のCOは、結合数の1つ多いOは+、Cの結合数は一つ少なく、孤立電子対を持つので-。H2Oは原子価通り、オキソニウムイオンのOは結合数が原子価より1つ多いので形式電荷は+になります。
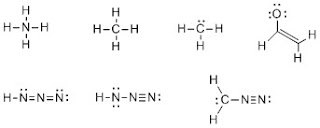
次の化学種のルイス構造式に形式電荷があれば書いてみましょう。
このようにLweis構造を描くことによって、有機化合物中の各原子の電子配置が明らかになります。例えば、共有電子対をいくつ持っているか? 孤立電子対を持っているか? 電荷の有無は? 電子対を持たない空軌道が存在するか? などです。もちろん、形式電荷や空軌道は分子を不安定にする要因はない方がよいのですが、少しは例外を認めても良いかと思います。Lewis構造を描くことによって、その構造がどの程度不安定なのかもわかるかと思います。



このコメントは投稿者によって削除されました。
返信削除質問やご意見は遠慮なくコメントください。 管理人
返信削除